W Pracowni Terapeutycznych Kwasów Nukleinowych Pracowni zajmujemy się syntezą modyfikowanych nukleozydów, nukleotydów i oligonukleotydów, jako modeli do zaawansowanych badań fizyko-chemicznych, strukturalnych i biologicznych. Badania koncentrują się wykorzystaniu modyfikowanych oligonukleotydów RNA do analizy zależności struktura-funkcja biologiczna transferowych RNA oraz do identyfikacji szlaków biosyntezy modyfikowanych nukleozydów występujących w naturalnych kwasach nukleinowych. Modele DNA modyfikowane klastrami boru stanowią platformę do syntezy funkcjonalnych nanostruktur o potencjalnym zastosowaniu w leczeniu raka i chorób cywilizacyjnych. Poszukujemy aktywnych terapeutycznych kwasów nukleinowych, wykazujących właściwości inhibitorów ekspresji genów (oligonukleotydy antysensowe, siRNA) lub inhibitorów aktywności enzymów białkowych (aptamery). Prowadzimy badania nad syntezą i funkcją analogów nukleotydów biorących udział w procesach metabolicznych komórki (trifosforanów nukleozydów, dinukleozydo-polifosforanów). Interesuje nas również funkcja białek oddziałujących z kwasami nukleinowymi, zaangażowanych w biosyntezę modyfikowanych nukleozydów występujących w tRNA, oraz białek z rodziny HIT oddziałujących z nukleotydowymi cząsteczkami sygnałowymi.
New paper just published:
Kulik, K.; Sadowska, K.; Wielgus, E.; Pacholczyk-Sienicka, B.; Sochacka, E.; Nawrot, B. Different Oxidation Pathways of 2-Selenouracil and 2-Thiouracil, Natural Components of Transfer RNA. Int. J. Mol. Sci. 2020, 21, 5956. Publication Certificate

Damian Kaniowski, Katarzyna Ebenryter-Olbinska, Katarzyna Kulik, Slawomir Janczak, Anna Maciaszek, Katarzyna Bednarska-Szczepaniak,
Barbara Nawrot and Zbigniew Lesnikowski: Boron clusters as a platform for new materials: composites of nucleic acids and oligofunctionalized carboranes (C2B10H12) and their assembly into functional nanoparticles.
Grant NCN, nr umowy: UMO-2015/16/W/ST5/00413 SYMFONIA 3
Oligopodalne kompozyty kwasów nukleinowych i klasterów boru – nowy materiał dla bionanotechnologii
Kierownik grantu: prof. dr hab. Barbara Nawrot. Projekt realziowany we wspolpracy z Centrum Biologii Medycznej, Lider Konsorcjum prof. dr hab. Zbigniew Leśnikowski
Grant realizowany od 16.11.2015 do 15.11 2021
Celem projektu jest przeprowadzenie badań nad możliwościami tworzenia nanstruktur kwasów nukleinowych dekorowanych klastrami boru.
W latach 2015-2017 opracowano metodę syntezy dekorowanych klastrami boru oligonukleotydów antysensowych (B-ASO) skierowanych na mRNA białka EFGR. Zbadano ich potencjał inhibitorowy anty-EGFR w modelu Dual Fluorescence Assay (wykorzystując komórki HeLa i plazmidowy system ekspresyjny tj. plazmid fuzyjny EGRF z GFP oraz plazmid RFP) i wykazano ich wysoką aktywność, zależną od pozycji klastra boru w łańcuchu ASO, rodzaju klastra oraz jego pozycji w strukturze nukleozydu (2’O- lub N3).
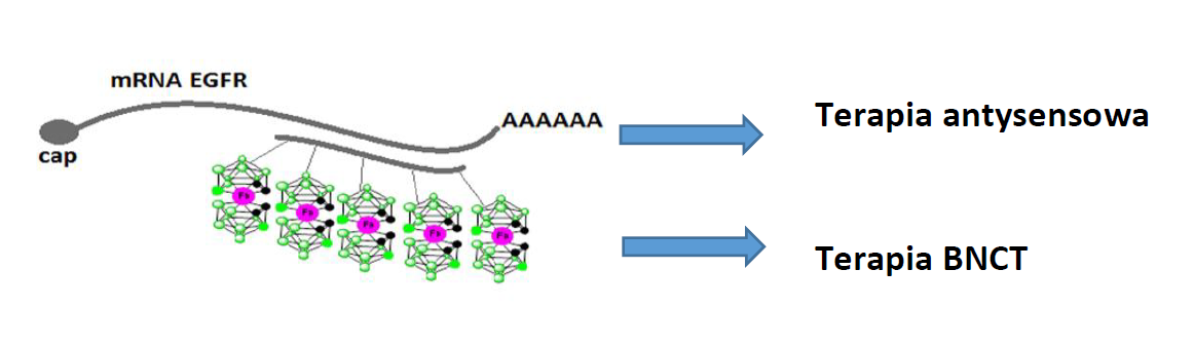
W latach 2018-2020 zaprojektowano i zsyntezowano modele B-ASO zdolne do tworzenia struktur wyższego rzędu (tzw. Dipody zawierające dwie nici ASO połączone klastrem boru, oraz dipody do nich komplementarne). Metodą AFM i Cryo-TEM scharakteryzowano strukturę przestrzenną kompleksów tych B-ASO (pierscienie zawierające 6-12 dipodów). Zbadano ich potencjał inhibitorowy anty-EGFR w modelu DFP oraz w modelu endogennym (w komórkach A431). Ponadto metodą ICP MS wykazano zdolność nanostruktur B-ASO do wprowadzania atomów boru bez czynnika transfekcyjnego, co ma znaczenie w planowanych badaniach niszczenia komórek nowotworowych z wykorzystaniem naświetlania termalnymi neuronami w tzw. metodzie BNCT (Boron Neutron Capture Therapy).
W roku 2021 kontynuowane są badania nad kolejnymi modelami B-ASO, tzw. tripedami. Badania są w toku.
Publikacje:
D. Kaniowski, K. Ebenryter-Olbinska, K. Kulik, S. Janczak, A. Maciaszek, K. Bednarska-Szczepaniak, B. Nawrot, Z. Leśnikowski. Boron clusters as a platform for new materials: composites of nucleic acids and oligofunctionalized carboranes (C2B10H12) and their assembly into functional nanoparticles. Nanoscale 7, 103-114 (2020)
D. Kaniowski, K. Kulik, K. Ebenryter-Olbińska, E. Wielgus, Z. Leśnikowski, B. Nawrot. Metallacarborane Complex Boosts the Rate of DNA Oligonucleotide Hydrolysis in the Reaction Catalyzed by Snake Venom Phosphodiesterase. Biomolecules, 10,718 (2020)
D. Kaniowski, K. Ebenryter-Olbinska, K. Kulik, A. Maciaszek, Z. Lesnikowski, B. Nawrot. Nanostructured conjugates of DNA oligonucleotides and boron clusters as potential dual-action anti-EGFR and BNCT therapeutics. FEBS OpenBio, 9, 209, (2019)
K. Ebenryter-Olbinska, D. Kaniowski, M. Sobczak, B. A. Wojtczak, S. Janczak, E. Wielgus, B. Nawrot, Z. J. Lesnikowski. Versatile Method for the Site-Specific Modification of DNA with Boron Clusters: Anti-Epidermal Growth Factor Receptor (EGFR) Antisense Oligonucleotide Case Chem. Eur. J., 23, 16535-16546 (2017)
D. Kaniowski, K. Ebenryter-Olbińska, M. Sobczak, B. Wojtczak, S. Janczak, Z. J. Leśnikowski, B. Nawrot. High boron-loaded DNA-oligomers as a potential boron neutron capture therapy and antisense oligonucleotide dual-action anticancer agents. Molecules, 22, #1393, 20 stron (2017)
Konferencje:
D. Kaniowski, K. Ebenryter-Olbińska, K. Kulik, A. Maciaszek, K. Maliszewska-Olejniczak, M. Gryziński, Z. J. Leśnikowski, B. Nawrot. Nanostructures of conjugates of antisense oligonucleotides and boron clusters as potential carriers for boron neutron capture therapy (BNCT). yBNCT, Helsinki, Finlandia, 26-29 września 2019 (prezentacja ustna)
D.Kaniowski, K.Ebenryter-Olbińska, K.Kulik, A.Maciaszek, Z.J. Leśnikowski, B.Nawrot, Nanostructures of conjugates of antisense oligonucleotides and boron clusters as potential dual – action therapeutic nucleic acids. IFF Spring School Forschugszentrum, Julich, Niemcy, 11-22 marca 2019 (plakat)
D.Kaniowski, K.Ebenryter-Olbińska, K.Kulik, A.Maciaszek, Z.J. Leśnikowski, B. Nawrot, Nanostructured conjugates of DNA oligonucleotides and boron clusters as potential dual-action anti-EGFR & BNCT therapeutics. 44th FEBS Congress, Kraków, Polska, 7-11 lipca 2019 (plakat)
D. Kaniowski, K. Ebenryter-Olbińska, K. Kulik, A. Maciaszek, Z.J. Leśnikowski, B. Nawrot. Nanostructured conjugates of DNA oligonucleotides and boron clusters as potential dual-action anti-EGFR therapeutic nucleic acids. 11th Joint Meeting on Medicinal Chemistry, Praga, Czechy, 27-30 czerwca 2019 (wykład)
D. Kaniowski, K. Ebenryter-Olbińska, K. Kulik, M. Sobczak, S. Janczak, Z. J. Leśnikowski, B. Nawrot. Oligopods of antisense oligonucleotides with boron clusters: self-assembly and biological properties. XXIII International Roundtable on Nucleosides, Nucleotides and Nucleic Acids, UC San Diego, La Jolla, California (USA), 26-30 sierpnia 2018 (plakat)
D. Kaniowski, K. Ebenryter-Olbińska, K. Kulik, A. Maciaszek, Z.J. Leśnikowski, B. Nawrot. Conjugates of antisense oligonucleotides with boron clusters: new material for anticancer therapy. 8th Intercollegiate Biotechnology Symposium 'Symbioza’, Warszawa, 17-19 maja 2019 (prezentacja ustna)
K. Kulik, A. Maciaszek, Z. J. Leśnikowski, B. Nawrot, Optimization of click reaction conditions on solid support for synthesis of oligofunctionalized carboranes. XXI International Symposium „Advances in the Chemistry of Heteroorganic Compounds”, Łódź, 23 listopada 2018
D. Kaniowski, K. Ebenryter-Olbińska, K. Kulik, M. Sobczak, S. Janczak, Z. J. Leśnikowski, B. Nawrot, Composites of Nucleic Acids and Oligofunctionalized Carboranes: synthesis, physicochemical and biological properties. XXI International Symposium „Advances in the Chemistry of Heteroorganic Compounds”, Łódź, 23 listopada 2018
D. Kaniowski, K. Ebenryter-Olbińska, K. Kulik, A. Maciaszek, Z. J. Leśnikowski, B. Nawrot Klastery boru skoniugowane z kwasami nukleinowymi – nowy materiał dla bionanotechnologii. STM/AFM NANOSAM, Zakopane 28-02 grudnia 2018
D. Kaniowski, K. Ebenryter-Olbińska, K. Kulik, M. Sobczak, S. Janczak, Z. J. Leśnikowski and B. Nawrot, Synthesis and physico-chemical and biological properties of oligopods of boron clusters and antisense oligonucleotides. XI Ogólnopolskie Sympozjum Chemii Organicznej, Warszawa, 8-11 kwietnia 2018
D. Kaniowski, K. Ebenryter-Olbińska, Z. J. Leśnikowski, B. Nawrot. Anti-EGFR silencing activity of antisense oligonucleotides labeled with boron clusters XVIIth Symposium on Chemistry of Nucleic Acid Components Český Krumlov, Czechy, 4-9.06. 2017, prezentacja plakatu
K. Ebenryter-Olbińska, M. Sobczak, D. Kaniowski, Z. J. Leśnikowski, B. Nawrot Synthesis and physicochemical characterization of antisense oligonucleotides modified with boron cluster
XVIIth Symposium on Chemistry of Nucleic Acid Components Český Krumlov, Czechy, 4-9.06. 2017, prezentacja plakatu
D. Kaniowski, K. Ebenryter-Olbińska, Z. J. Leśnikowski, B. Nawrot. Heavily boron-cluster-modified anti-EGFR antisense oligonucleotides, I konferencja doktorantów PAN, Falenty, 23-25.06.2017
D. Kaniowski, K. Ebenryter-Olbińska, Z. J. Leśnikowski, B. Nawrot. Anti-EGFR antisense oligonucleotides conjugated with metallocarboranyl clusters 60 Zjazd naukowy Polskiego Towarzystwa Chemicznego, 18.09.2017, Wrocław.
Katarzyna Ebenryter-Olbińska, Zbigniew J. Leśnikowski, Barbara Nawrot. Post-synthetic modification of DNA-oligonucleotides with boron clusters using “click chemistry” methodology. X Jakub K. Parnas Conference, 10-12 lipca 2016, Wrocław
Damian Kaniowski, Barbara Nawrot. Development of a dual fluorescence assay for monitoring of anti-EGFR silencing activity of chemically modified oligonucleotides; construction of pGFP-EGFR fusion plasmid. Parnas Conference, 10-12 lipca 2016, Wrocław
Katarzyna Ebenryter-Olbińska, Zbigniew J. Leśnikowski, Barbara Nawrot. Post-synthetic modification of DNA-oligonucleotides with boron clusters using “click chemistry” methodology. 59. Zjazd PTChem, 19-23 września 2016, Poznań
Damian Kaniowski, Barbara Nawrot. Development of a dual fluorescence assay for monitoring of anti-EGFR silencing activity of chemically modified oligonucleotides; construction of pGFP-EGFR fusion plasmid. 59. Zjazd PTChem, 19-23 września 2016, Poznań
Katarzyna Ebenryter-Olbińska, Damian Kaniowski, Zbigniew J. Leśnikowski, Barbara Nawrot. Synthesis, physicochemical and biological properties of DNA oligonucleotides modified with boron clusters. XIX International Symposium “Advances in the Chemistry of Heteroorganic Compounds”, 25 listopada 2016
Grant NCN, nr umowy: UMO-2018/29/B/ST5/02509 OPUS 15
Dlaczego Natura wprowadziła selen do nukleozydów w pozycji wahadłowej bakteryjnych tRNA?
Kierownik grantu: prof. dr hab. Barbara Nawrot
Grant realizowany 24.01.2019-23.01.2022
Celem projektu jest zbadanie biologicznej funkcji selenonukleozydów obecnych w pierwszej pozycji antykodonu transferowych RNA (tRNA) obecnych w bakteriach.
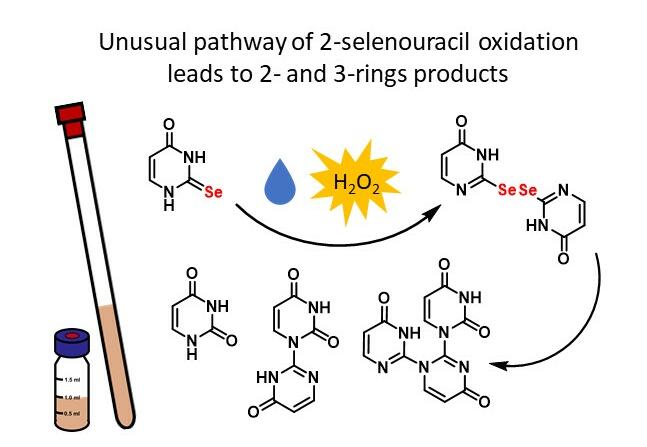
W roku 2019 przeprowadzono badania, które wykazały że 5-podstawione 2-selenourydyny preferencyjnie tworzą pary z resztami guanozyny a nie adenozyny (Leszczynska et al. IJMS 2020), co ma znaczenie w efektywnego rozpoznaniu synonimowych antykodonów, zawierających jednostkę purynową 3’-terminalną (A lub G) przez antykodony tRNA zawierające Se2U. Zbadano i opublikowano proponowany mechanizm utleniania 2-seleno- i 2-tiouracylu (Kulik et al. IJMS 2020) i skonkuldowano, że same seleno- i tio-nukleozasady nie stanowią dobrych modeli do analizy procesu utleniania S/Se2U-tRNA w stresie oksydacyjnym.
W roku 2020 kontunuowano badania reaktywności Se2U oraz S2U wobec nadtlenku wodoru. Wykonano także badania uzupełniające do pełnego scharakteryzowania białka SelU, które katalizuje reakcję geranylowania S2U-RNA i reakcję selenowania geS2U-RNA.
W roku 2021 prowadzone są badania epitranskrptomu w bakteryjnych tRNA.
Publikacje
Kulik, K.; Sadowska, K.; Wielgus, E.; Pacholczyk-Sienicka, B.; Sochacka, E.; Nawrot, B. Different Oxidation Pathways of 2-Selenouracil and 2-Thiouracil, Natural Components of Transfer RNA. Int. J. Mol. Sci., 21, 5956. (2020)
Leszczynska G., Cypryk M., Gostynski B., Sadowska K., Herman P., Bujacz G., Lodyga-Chruscinska E., Sochacka E., Nawrot B. C5-Substituted 2-Selenouridines Ensure Efficient Base Pairing with Guanosine; Consequences for Reading the NNG-3′ Synonymous mRNA Codons. Int. J. Mol. Sci., 21, pii: E2882. (2020)
Konferencje / wykłady
Barbara Nawrot, C5-Substituted 2-Selenouridines Ensure Efficient Base Pairing with Guanosine; Consequences for Reading the NNG-3′ Synonymous mRNA Codons. Advances in Nucleic Acid Therapeutics and Related Compounds (on line), 15.10.2020, Łódź
B. Nawrot wykład na zaproszenie Komitetu Biologii Molekularnej Komórki PAN, Epitranskryptomika na poziomie tRNA, Posiedzenie Komitetu Biologii Molekularnej Komórki PAN, 6 marca 2020 r.
Grant NCN, nr umowy: UMO-2016/23/B/NZ1/02316 OPUS 12
Badanie uszkodzeń 2-tiourydyno-tRNA zachodzących w komórkach poddanych stresowi oksydacyjnemu.
Kierownik grantu: dr Małgorzata Barbara Sierant
Grant realizowany od 28.09.2017 do 27.09.2021
Celem projektu jest zbadanie czy w komórkach eukariotycznych pod wpływem stresu oksydacyjnego dochodzi do uszkodzeń tRNA, polegających na desulfuracji 5-podstawionej 2-tiourydyny (R5S2U), występującej w pozycji 1 antykodonu tRNALys, tRNAGlu i tRNAGln, z utworzeniem rybozydu 4-pirymidynonu (R5H2U) i urydyny (R5U).
W latach 2017-2020 prowadzono badania na komórkach drożdży Saccharomyce cerevisiae oraz na kilkunastu liniach ludzkich komórek nowotworowych. W celu wywołania stresu oksydacyjnego komórki podczas hodowli poddawano działaniu czynników utleniających, takich jak nadtlenek wodoru, arsenin sodowy czy podchloryn sodu, zastosowanych w stężeniach, w którym nie dochodziło do uszkodzenia i śmierci komórek. Wyznaczono poziom reaktywnych form tlenu jakie tworza się w komórkach pod wpływem zastosowanych czynników i mogą być przyczyną uszkodzeń komórkowych kwasów nukleinowych (w tym tRNA) i białek. Zaobserwowano, że zastosowanie warunków oksydacyjnych wobec komórek drożdży powodowało ubytek tRNA zawierającego modyfikację mcm5S2U w pozycji „wobble” pętli antykodonu, co mogło świadczyć o oksydacyjnym uszkodzeniu 2-tiourydyno-tRNA. Podjęto próby identyfikacji uszkodzonych nukleozydów w tRNA z komórek drożdży i ludzkich komórek nowotworowych metodą LC-MS/MS. tRNA wyizolowane z badanych komórek poddawano hydrolizie enzymatycznej a uzyskaną mieszaninę nukleozyców poddawano analizie masowej, bazując na zdefiniowanych wzorcach modyfikowanych nukleozydów typu R5S2U, R5H2U i R5U. Analiza LC MS/MS potwierdziła obecność poszukiwanych nukleozydów mcm5H2U i mcm5U, które mogą pochodzić z reakcji desulfuracji mcm5S2U, oraz niewielki spadek ilości mcm5S2U, co może być oznaką desulfuracji lub uszkodzeń enzymów odpowiedzialnych za modyfikację tRNA.
W roku 2021 Kontynuowane są badania mające na celu wyjaśnienie wpływu stresu oksydacyjnego na uszkodzenia tRNA w komórkach z deficytem enzymów systemu antyoksydacyjnego (SOD i Kat).
Publikacje
Malgorzata Sierant, Patrycja Komar, Rafal Szewczyk, Agnieszka Dziergowska, Elżbieta Sochacka, and Barbara Nawrot.. Studies on the oxidative damage of wobble 5-methylcarboxymethyl-2-thiouridine in transfer RNAs. Acta Biochimica Pol. 65, S2, 18, 2018.
M. Sierant, R. Szewczyk, A. Dziergowska, K. Krolewska-Golinska, E. Sochacka, B. Nawrot. Studies on the 2-thiouridine-tRNA damage induced in the Saccharomyces cerevisiae yeast cells under oxidative stress conditions. FEBS OpenBio 9, S1, 190, 2019.
Konferencje:
Malgorzata Sierant,*Patrycja Komar, Rafal Szewczyk, Agnieszka Dziergowska, Elżbieta Sochacka, and Barbara Nawrot. Studies on the oxidative damage of wobble 5-methylcarboxymethyl-2-thiouridine in transfer RNAs. Congress BIO2018, Gdańsk 18-21.09.2018.
M. Sierant, R. Szewczyk, A. Dziergowska, K. Krolewska-Golinska, E. Sochacka, B. Nawrot. Studies on the 2-thiouridine-tRNA damage induced in the Saccharomyces cerevisiae yeast cells under oxidative stress conditions. 44th FEBS Congress, 6-11 lipiec, Kraków, Polska.
Grant NCN, nr umowy: UMO-2020/36/T/ST4/00485 ETIUDA 8
Oligonukleotydy antysensowe i ich nanostruktury skoniugowane z klastrami boru; charakterystyka fizykochemiczna i biologiczna – próby oszacowania potencjału badanych związków do zastosowania w terapii BNCT.
Kierownik grantu: mgr Damian Kaniowski
Grant realizowany od 01.10.2020 – 30.09.2021
Celem projektu jest zbadanie użyteczności w terapii BNCT nowych nośników boru, jakimi są konjugaty klasterów boru z krótkimi antysensowymi olignukleotydami DNA (B-ASO), w tym przypadku skierowanymi na gen EFGR. Badania BNCT zostaną przeprowadzone podczas stażu naukowego na Uniwersytecie w Pawii, Włochy.
INNE GRANTY
Granty dla młodych naukowców:
2020
Mgr Patrycja Szczupak: Badanie elementów rozpoznawania substratów do prenylowania S2U-RNA oraz prenylowych-RNA przez 2-selenourydyno syntazę tRNA.
Mgr Damian Kaniowski: Identyfikacja i charakterystyka białek komórkowych wiążących się do modelowych koniugatów azydków boranowych z biotyną.
Dr Katarzyna Ebenryter-Olbińska: Synteza koniugatów kwasów nukleinowych i klasterów boru funkcjonalizowanych cząsteczkami fluoresceiny, galaktozaminy oraz biotyny.
Dr Ewa Radzikowska-Cieciura: Identyfikacja elementów odpowiedzialnych za rozpoznanie substratu przez enzym tRNA 2-selenourydyno syntazę (SeIU) z E. coli podczas katalizowanej przez SeIU reakcji selenowania prowadzącej do przekształcenia odpowiedniego prenylowego-tRNA do Se2U-tRNA
2019:
Mgr Damian Kaniowski: Zbadanie aktywności hydrolitycznej 3’- i 5’-egzonukleaz w obecności oligonukleotydów antysensowych (ASO) dekorowanych klastrami boru.
Od kilku lat obiektem naszych zainteresowań są modyfikacje chemiczne nukleozydów znajdujące się w tzw. „pozycji wahadłowej” antykodonu w transportującym kwasie rybonukleinowym (tRNA). Nukleozydy występujące w tej pozycji pełnią niezwykle istotną rolę w prawidłowym odczycie informacji genetycznej w procesie biosyntezy białka. W szczególności interesują nas 5-podstawione 2-tiourydyny (R5S2U), występujące tylko w trzech rodzajach tRNA: specyficznych dla lizyny, kwasu glutaminowego czy glutaminy (tRNALys, tRNAGlu i tRNAGln). W badaniach realizowanych wspólnie z zespołem Prof. Elżbiety Sochackiej, odkryliśmy, że w warunkach stresu oksydacyjnego in vitro 2-tiourydyna ulega desulfuracji, tzn. usunięciu atomu siarki z cząsteczki, a produktami tej reakcji są urydyna (U) i nukleozyd 4-pirymidynonu (H2U), w którym nie ma już atomu siarki, a układ donorów i akceptorów jest odmienny od urydyny i 2-tiourydyny. Produkty reakcji desulfuracji 2-tiourydyny można potraktować jako uszkodzenie tRNA, ponieważ nie może prawidłowo pełnić swojej funkcji. Obecnie pracujemy nad wyjaśnieniem czy omawiany proces desulfuracji 2-tiourydyny występuje również w warunkach naturalnych, w komórkach eukariotycznych poddanych stresowi oksydacyjnemu.
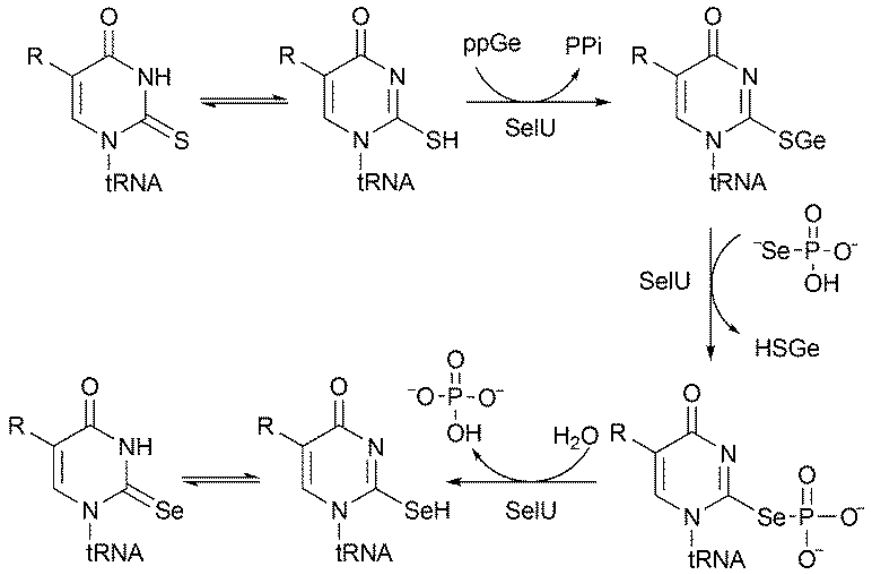
Niedawno w naszym Zespole został odkryty mechanizm transformacji 2-tiourydyny (S2U) do 2-selenourydyny (Se2U) w łańcuchu RNA. Wykazaliśmy, że w pierwszym etapie S2U jest przekształcana w S-geranylo-2-tiourydynę stanowiącą związek pośredni w syntezie Se2U (Schemat poniżej). Oba te procesy są katalizowane przez bakteryjny enzym tRNA 2-selenourydyno syntazę (SelU). Obecnie prowadzimy badania, których celem jest wyjaśnienie na poziome molekularnym funkcji selenu w nukleozydach występujących w pozycji wahadłowej transferowego RNA.
Odkryty przez nas mechanizm transformacji 2-tiouryduno-tRNA do 2-selenourydyno-tRNA opublikowany został w roku 2018 w czasopiśmie FEBS Letters (Sierant et al. FEBS Lett. 592(13), 2248-2258, 2018).
W ramach konsorcjum z Instytutem Biologii Medycznej PAN w Łodzi (zespół Prof. dr hab. Zbigniewa Leśnikowskiego) prowadzimy badania nad wytworzeniem nowych kompozytów bioorganicznych składających się z kwasów nukleinowych (DNA) oraz klasterów boru, zbadaniem ich właściwości fizykochemicznych oraz wykorzystaniem jako bloków budulcowych do tworzenia nanostruktur.
W ramach prowadzonych badań zajmujemy się m.in. syntezą modyfikowanych i niemodyfikowanych terapeutycznych oligonukleotydów antysensowych (ASO) skierowanych na gen receptora EGF, ich post-syntetyczną modyfikacją resztami karboranylowymi (o-karboranami i metalokarboranami) oraz charakterystyką spektralną uzyskanych związków (HPLC, MS, UV, CD). Realizacja projektu wymaga również prowadzenia syntez oligopodalnych bloków budulcowych (DNA-oligopodów/ oligofunkcjonalizowanych klasterów boru) metodą „na fazie stałej”, fizykochemicznej i biochemicznej charakterystyki otrzymanych oligopodalnych bloków budulcowych oraz badania ich zdolności do tworzenia struktur 2D i 3D, a także topologii tych struktur (AFM, Cryo-TEM). Istotny element realizowanego projektu stanowią badania biologiczne (m.in. ocena poziomu egzo- i endogennego białka EGFR w liniach nowotworowych, ocena cytotoksyczności, zmian proliferacyjnych, stabilności nukleolitycznej, stresu oksydacyjnego) przeprowadzane dla uzyskiwanych związków oraz nanostruktur.
Badania obejmują krystalizację, pomiary dyfraktometryczne monokryształów oraz rozwiązanie i udokładnienie otrzymanych struktur kwasów nukleinowych i oligonukleotydów, białek (głownie niałek z rodziny HIT) i ich kompleksów z wybranymi ligandami (modyfikowany aptamer trombiny skompleksowany z trombiną, białko FHIT z niehydrolizowanym analogiem Ap4A) oraz związków niskocząsteczkowych, np. pochodnych nukleozydów i nukleotydów oraz innych związków biologicznie aktywnych, m.in. potencjalnych leków. Poznanie pełnej struktury badanych cząsteczek oraz sposobu oddziaływań międzycząsteczkowych pozwala na określenie np. mechanizmu działania leków, czy mechanizmów aktywności enzymatycznej wybranych białek. W naszym Instytucie istnieje możliwość prowadzenia eksperymentów dyfrakcyjnych z wykorzystaniem promieniowania synchrotronowego na synchrotronach DESY (Hamburg, Niemcy) i BESSY (Berlin, Niemcy). Obecnie na terenie CBMiM trwają przygotowania do otwarcia pracowni dyfraktometrycznej wyposażonej w rentgenowski dyfraktometr monokrystaliczny i dyfraktometr proszkowy.
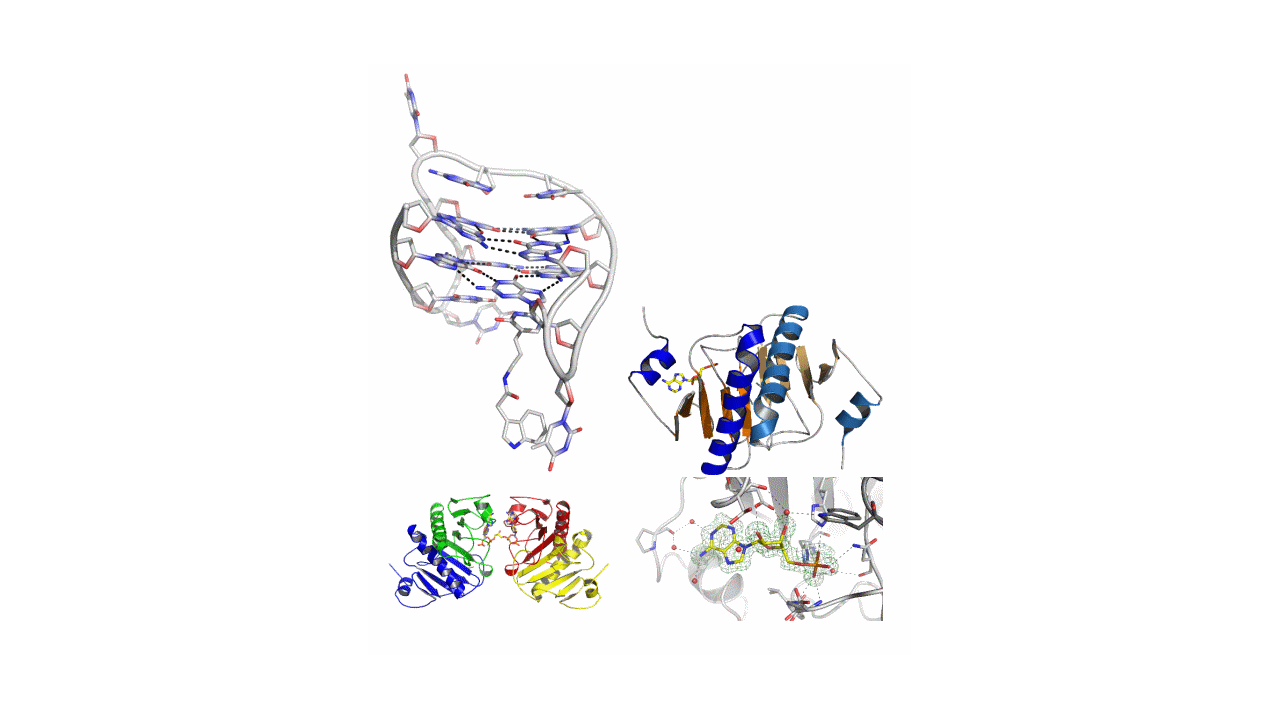
W ramach tego tematu wyjaśniony został mechanizm apoptozy indukowanej przez białko Fhit przy użyciu niehydrolizowalnych analogów Ap4A (oryginalnie zaprojektowanych i zsyntezowanych w naszym Dziale) i będących inhibitorami własności enzymatycznych badanego białka (Krakowiak et al., Biol.Med.Chem. 11 (2011) 5053). Ponadto, odkryto nowy region oddziaływania pomiędzy białkiem Fhit a substratem/analogiem substratu (Krakowiak et al. FEBS Lett. 591 (2017), 548).
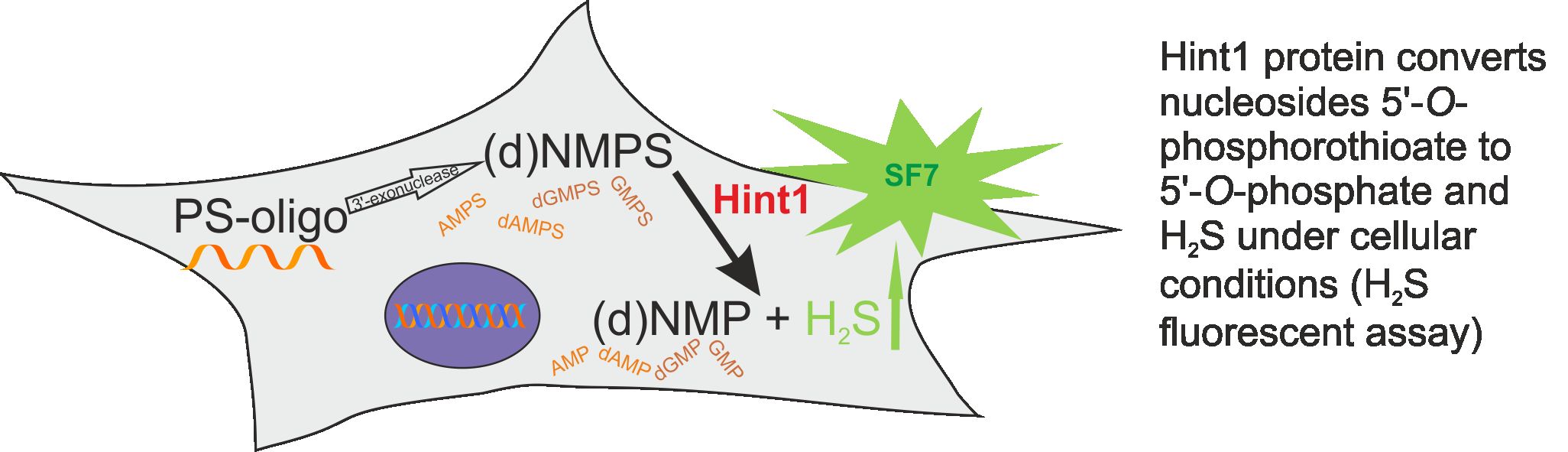
W badaniach dotyczących fosforoamidazy Hint1 określono, jaka jest stereochemia hydrolizy wiązania P-N w pochodnych nukleozydowych amidotiofosforanów (Krakowiak et al. Chem.Comm. 2007, 2163). Ponadto, stwierdzono że Hint1 wykazuje także właściwości desulfurazy 5’-O-tiofosforanów nukleozydów i odkryto, że w tej reakcji wydziela się siarkowodór (Ozga et al. J.Biol.Chem. 285 (2010), 40809), o którym wiadomo że w warunkach fizjologicznych ma znaczenie w etiologii wielu chorób (np. nadciśnienie, choroba Alzheimera). Dalsze badania wykazały, że powyższa reakcja desulfuracji z udziałem enzymu Hint1 zachodzi również wewnątrz komórek (Rysunek poniżej, Krakowiak et al. BBA, 1840 (2014) 3357; Krakowiak et al., Biochem.Pharm. 163 (2019) 250), co może mieć znaczenie zarówno w terapii antysensowej z zastosowaniem tiofosforanowych analogów oligonukleotydów, jak również w możliwym zastosowaniu tiofosforanowych analogów nukleozydów jako donorów H2S w leczeniu pewnych chorób.