
Nasze badania skupiają się w szczególności wokół pęcherzyków zewnątrzkomórkowych (egzosomów) i ich znaczenia w rozwoju chorób takich jak nowotwory czy choroby o podłożu zapalnym. Pęcherzyki zewnątrzkomórkowe to niewielkie struktury błoniaste wydzielane przez wszystkie żywe komórki, niosące ze sobą informację biologiczną w postaci kwasów nukleinowych (różne formy RNA), lipidów i białek. Proces wydzielania pęcherzyków i ładunek który niosą podlegają ścisłej regulacji i są zależne od warunków w jakich komórki ludzkie aktualnie się znajdują. Komunikacja międzykomórkowa za pomocą pęcherzyków ma szczególne znaczenie w kontekście odpowiedzi układu odpornościowego na zagrożenia takie jak infekcje czy nowotwory. Poprzez wymianę pęcherzyków o modyfikowanej zawartości komórki są w stanie przesyłać między sobą różne sygnały umożliwiające koordynację układu odpornościowego. Te zależności są obiektem badań naszej grupy, w której prowadzimy badania zarówno na ludzkich komórkach podstawowych jak i liniach nowotworowych.
Głównym celem naszej grupy jest badanie nowych mechanizmów regulacyjnych kierujących sekrecją i selekcją ładunku pęcherzyków pozakomórkowych. Chcemy zrozumieć w jaki sposób komórki nowotworowe wykorzystują wydzielane pęcherzyki do hamowania odpowiedzi odpornościowej w ludzkim ciele. Obecnie zajmujemy się wykorzystaniem mechanizmów komunikacji międzykomórkowej stosowanej przez nowotwory w celu stworzenia elementu wspierającego terapię przeciwnowotworową. Naszym celem jest modulacja komórek nowotworowych w taki sposób aby zahamować wydzielanie egzosomów a same komórki uwrażliwić na terapię przeciwnowotworową.
Badania prowadzone są zarówno w ramach badań statutowych Instytutu, jak i w ramach projektów Narodowego Centrum Nauki.
Jeśli chcesz dowiedzieć się więcej o naszych projektach lub chcesz z nami współpracować
SKONTAKTUJ SIĘ Z NAMI I DOŁĄCZ DO NASZEGO ZESPOŁU!
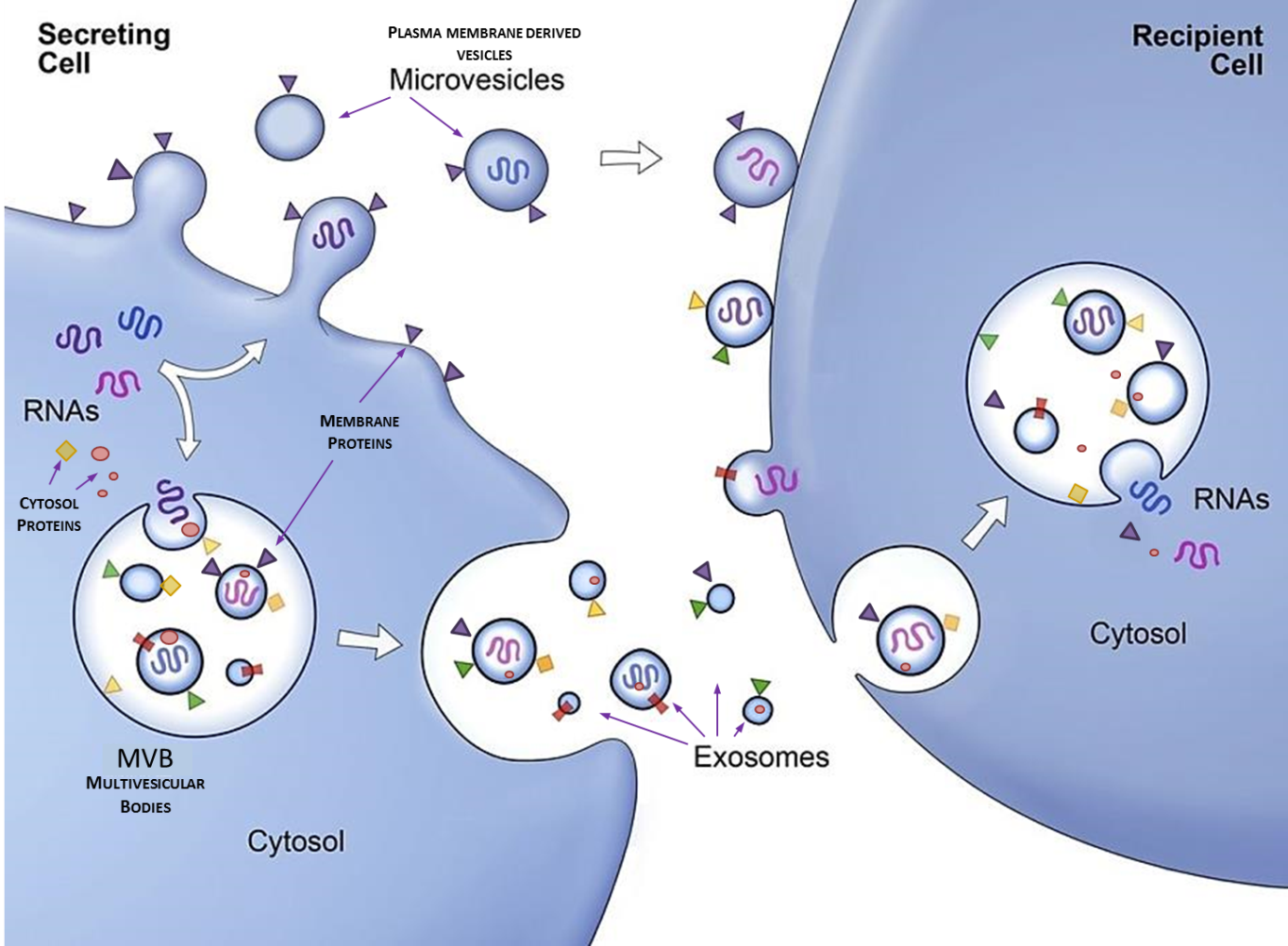

Projekty obecnie realizowane ze środków Narodowego Centrum Nauki w Zespole:
1. Egzosomy z czerniaka i indukcja antygenowo-zależnej tolerancji immunologicznej
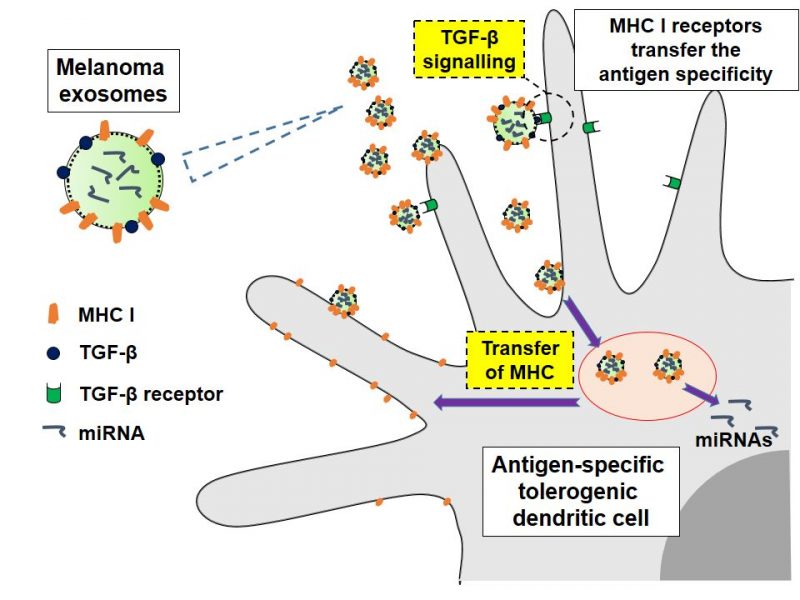
Tłumienie przeciwnowotworowej odpowiedzi immunologicznej ma zasadnicze znaczenie dla przetrwania i rozwoju nowotworów. Zjawisko to jednak jest różne dla różnych typów nowotworu i ma charakter antygenowo-swoisty, tzn. zależny od antygenów rozpoznawanych w komórkach nowotworowych, i nie jest dobrze poznane. Nasze badania skupiają się na znaczeniu małych pęcherzyków zewnątrzkomórkowych (np. egzosomów) w immunosupresji. Pęcherzyki te są udekorowane cząsteczkami białek głównego układu zgodności tkankowej (MHC) klasy I, a zatem mogą wiązać i przenosić specyficzne antygeny nowotworowe. Mogą także przenosić kompleksy MHC-antygen do komórek prezentujących antygen w procesie zwanym cross-dressing. Jednocześnie, pęcherzyki niosą ze sobą ładunek innych białek, np. cytokin i miRNA, które są w stanie indukować w komórkach akceptorowych fenotyp immunosupresyjny, doprowadzając do stanu tolerancji antygenowo-swoistej i zahamowaniu naturalnych mechanizmów obrony przed komórkami nowotworowymi. Nasze wyniki potwierdzają występowanie takiego zjawiska.
2. Tworzenie immunosupresyjnych egzosomów
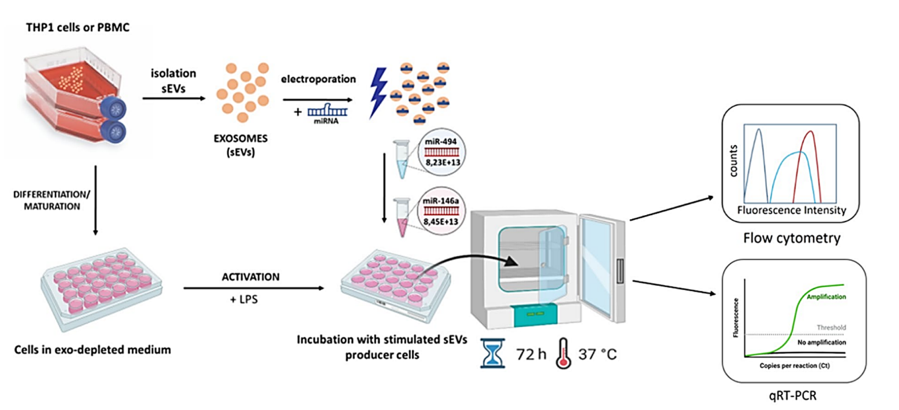
Wyżej opisany proces wymiany informacji poprzez transport pęcherzykowy pozwala nowotworowi przetrwać w środowisku układu odpornościowego człowieka. Tę samą strategię można także zastosować w w celu odwrócenia niekorzystnego procesu – tworząc pęcherzyki których ładunek pozwoli na wyciszenie niechcianej immunosupresji. Taki efekt byłby pożądany np. w celu przeciwdziałania zjawisku odrzucenia przeszczepu, który często towarzyszy transplantacjom i wymaga podawania silnych leków immunosupresyjnych upośledzających cały układ odpornościowy pacjenta. Modyfikowane pęcherzyki które miałyby właściwości immunosupresyjne ale działające wybiórczo, czyli antygenowo-specyficznie byłyby doskonałym narzędziem pomocniczym w leczeniu chorób autoimmunologicznych czy wspomagając leczenie choroby przeszczep przeciw gospodarzowi.
Nasze badania potwierdzają, że pęcherzyki zewnątrzkomórkowe można wykorzystać do stworzenia narzędzi hamujących układ odpornościowy korzystając ze strategii podobnej do tej stosowanej przez nowotwory. Eksperymenty pokazują, że prosta manipulacja pęcherzyków taka jak ładowanie ich immunosupresyjnym miRNA przy pomocy elektroporacji, może prowadzić do zahamowania dojrzewania DC poprzez zmniejszenie ekspresji cząsteczek MHC na powierzchni komórek docelowych.
3. Sygnałowanie i wydzielanie pęcherzyków zewnątrzkomórkowych w procesie zapalnym
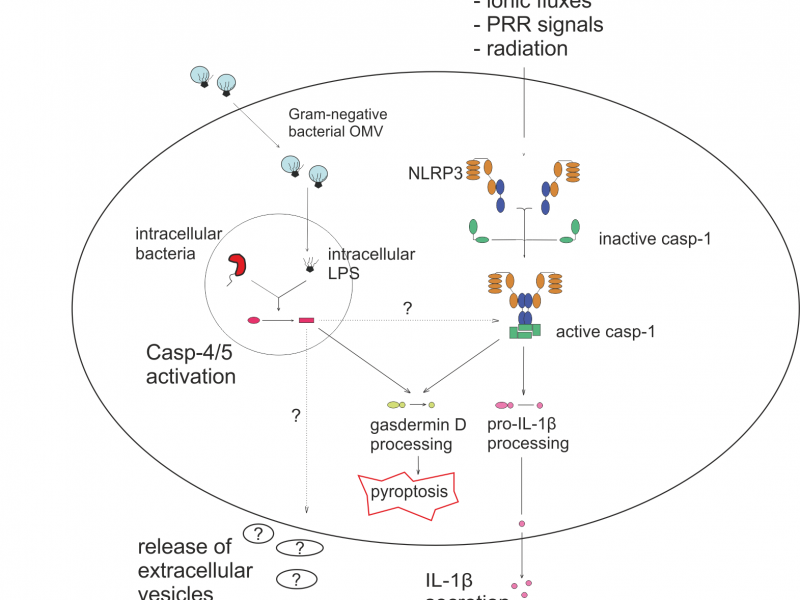 Proces wydzielania pęcherzyków zewnątrz- komórkowych oraz ich ładunek jest ściśle regulowany i zależny od stanu w jakim znajdują się komórki układu odpornościowego. W przeszłości nasze badania pokazały że indukcja stanu zapalnego, jaka często towarzyszy infekcji czy chorobom auto- immunologicznym w zasadniczy sposób wpływa na wydzielanie pęcherzyków z makrofagów. W naszych badaniach dążymy do poznania tej zależności i zidentyfikowania szlaków sygnałowych które regulują pęcherzykowaniem oraz wpływają na zawartość pęcherzyków która stanowi o ich właściwościach. W szczególności staramy się ustalić jaką rolę w procesie pęcherzykowania odgrywa inflamasom NLRP3 i jego kanoniczna oraz niedawno odkryta niekanoniczna aktywacja.
Proces wydzielania pęcherzyków zewnątrz- komórkowych oraz ich ładunek jest ściśle regulowany i zależny od stanu w jakim znajdują się komórki układu odpornościowego. W przeszłości nasze badania pokazały że indukcja stanu zapalnego, jaka często towarzyszy infekcji czy chorobom auto- immunologicznym w zasadniczy sposób wpływa na wydzielanie pęcherzyków z makrofagów. W naszych badaniach dążymy do poznania tej zależności i zidentyfikowania szlaków sygnałowych które regulują pęcherzykowaniem oraz wpływają na zawartość pęcherzyków która stanowi o ich właściwościach. W szczególności staramy się ustalić jaką rolę w procesie pęcherzykowania odgrywa inflamasom NLRP3 i jego kanoniczna oraz niedawno odkryta niekanoniczna aktywacja.
4. Proteomika i transkryptomika pęcherzyków zewnątrzkomórkowych
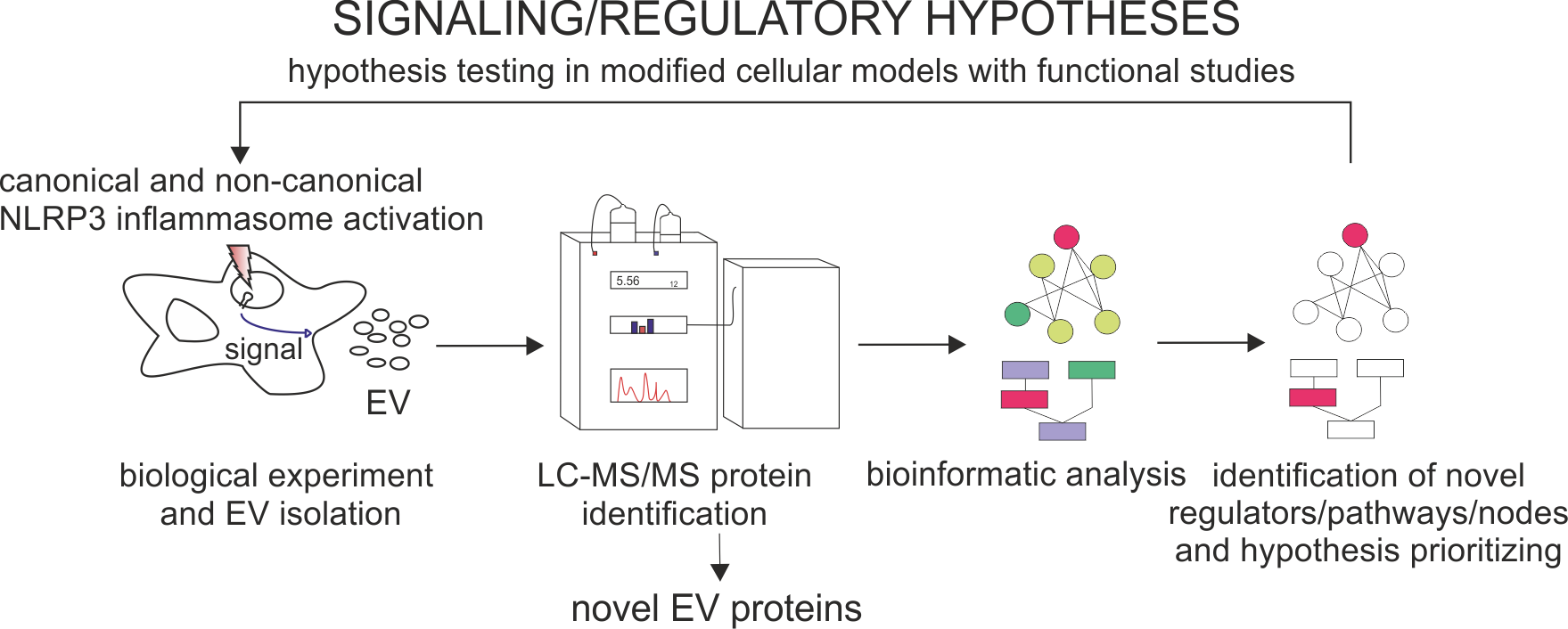 We współpracy z Uniwersytetami w Helsinkach i Oslo prowadzimy także badania proteomiczne nad zmianami składu białkowego pęcherzyków za pomocą spektrometrii mas, analiz bioinformatycznych i biochemicznych które pozwalają ustalić jakie role w regulacji działania układu odpornościowego mogą odgrywać pęcherzyki wydzielane w procesie zapalnym. Informacje na temat składu białkowego mogą także być źródłem analiz dotyczących sygnałów regulujących ich wydzielaniem oraz ich właściwości w przesyle informacji międzykomórkowej.
We współpracy z Uniwersytetami w Helsinkach i Oslo prowadzimy także badania proteomiczne nad zmianami składu białkowego pęcherzyków za pomocą spektrometrii mas, analiz bioinformatycznych i biochemicznych które pozwalają ustalić jakie role w regulacji działania układu odpornościowego mogą odgrywać pęcherzyki wydzielane w procesie zapalnym. Informacje na temat składu białkowego mogą także być źródłem analiz dotyczących sygnałów regulujących ich wydzielaniem oraz ich właściwości w przesyle informacji międzykomórkowej.
5. Nowe metody oczyszczaniem populacji pęcherzyków.
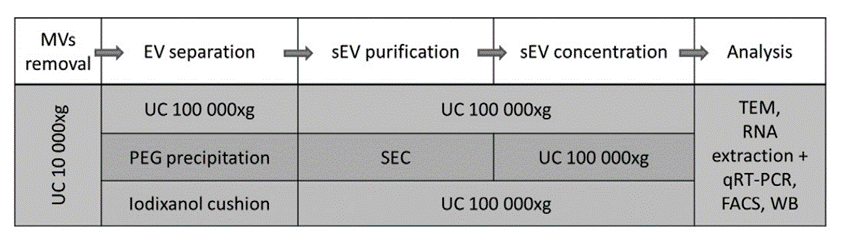
Pęcherzyki zewnątrzkomórkowe, w tym egzosomy, otrzymuje się z różnych płynów biologicznych – zarówno płynów ustrojowych jak i płynów po hodowli tkankowej. Niestety rozdzielenie populacji pęcherzyków (np. małych egzosomów od dużych mikropęcherzyków) nie jest łatwe i brakuje metod laboratoryjnych umożliwiających otrzymanie czystej populacji homogennych pęcherzyków, które mogłoby być stosowane w terapii. Nasze badania skupiają się także na opracowywaniu nowych metod oczyszczania egzosomów poprzez użycie wirowania w gradiencie gęstości, wytrącania z roztworu czy zastosowanie chromatografii wykluczenia. Weryfikacja czystości tak otrzymanych populacji odbywa się np. za pomocą obserwacji pod mikroskopem elektronowym, a także metodami biochemicznymi, takimi jak pomiary składu RNA oraz wybranych markerów RNA, białek, za pomocą metod żelowych i cytometrii przepływowej.
6. Modulowanie produkcji egzosomów jako element wspierający terapię przeciwnowotworową
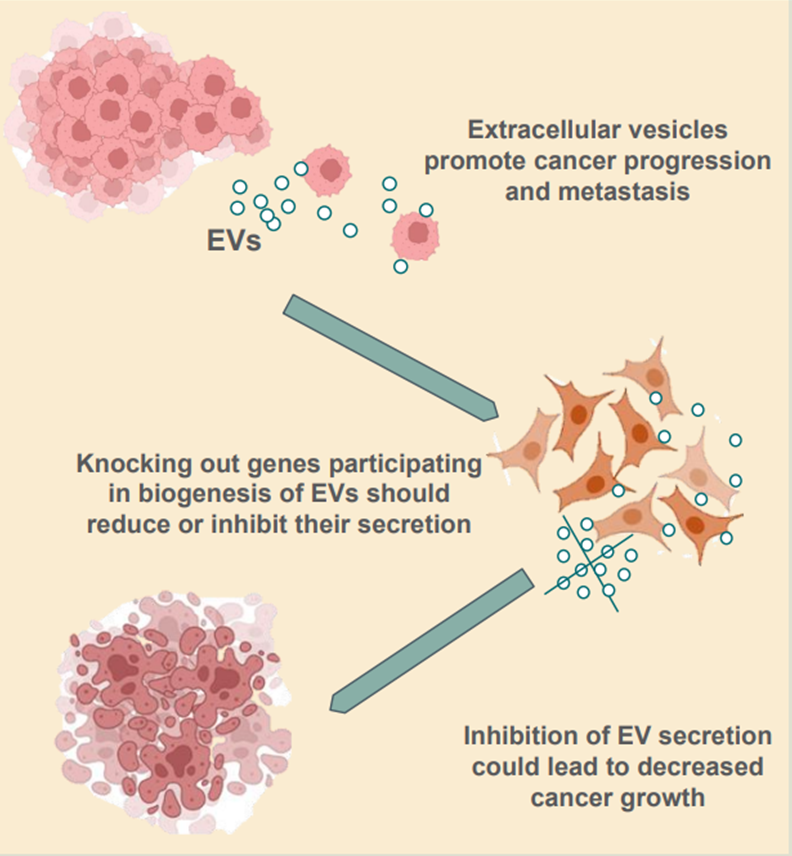
W ludzkim ciele każdego dnia powstają potencjalne komórki nowotworowe. Tylko wtedy, gdy komórka nowotworowa jest w stanie uniknąć odpowiedzi immunologicznej gospodarza, może zacząć rosnąć. Komórki nowotworowe muszą intensywnie komunikować się z innymi komórkami organizmu, aby uniknąć zniszczenia przez układ odpornościowy i zorganizować odpowiednie zapotrzebowanie. Egzosomy pomagają wyłączyć przeciwnowotworową odpowiedź immunologiczną gospodarza i indukować angiogenezę. Wspomagają przeżycie komórek nowotworowych na wiele różnych sposobów. Na przykład egzosomy eksportują z komórki na zewnątrz substancje szkodliwe dla komórki nowotworowej, takie jak leki cytotoksyczne stosowane w chemioterapii. U niektórych pacjentów z rakiem zakłócenie przeciwnowotworowej odpowiedzi immunologicznej może być całkowicie zależne od aktywności egzosomów. Dlatego też, przypuszczamy że zablokowanie produkcji egzosomów w komórkach nowotworowych ułatwi terapie przeciwnowotworowe, a nawet może indukować odporność. Głównym celem proponowanego projektu jest scharakteryzowanie in vitro komórek czerniaka, w których produkcja i sekrecja egzosomów została zaburzona, aby zbadać możliwość zastosowania jako podejścia terapeutycznego.
Cypryk W.; Czernek L.; Horodecka K.; Chrzanowski J.; Stańczak M.; Nurmi K.; Bilicka M.; Gadzinowski M.; Walczak-Drzewiecka A.; Stensland M.; Eklund K.; Fendler W.; Nyman T., and Matikainen S. Lipopolysaccharide Primes Human Macrophages for Noncanonical Inflammasome-Induced Extracellular Vesicle Secretion. Journal of Immunology. 2023, 210:(3):322-334
Czernek L., Pęczek Ł. & Düchler M. Small Extracellular Vesicles Loaded with Immunosuppressive miRNAs Leads to an Inhibition of Dendritic Cell Maturation. Arch. Immunol. Ther. Exp. 2022, 70, 27
Kluszczyńska K, Pęczek Ł, Różański A, Czernek L, Duechler M. U6/miR-211 expression ratio as a purity parameter for HEK293 cell-derived exosomes. Acta Biochim Pol. 2022, 69(2):409-415
Horodecka K, Düchler M. CRISPR/Cas9: Principle, Applications, and Delivery through Extracellular Vesicles. Int J Mol Sci. 2021, 22(11):6072.
Brambilla D, Sola L, Ferretti AM, Chiodi E, Zarovni N, Fortunato D, Criscuoli M, Dolo V, Giusti I, Murdica V, Kluszczyńska K, Czernek L, Düchler M, Vago R, Chiari M. EV Separation: Release of Intact Extracellular Vesicles Immunocaptured on Magnetic Particles. Anal Chem. 2021, 93(13):5476-5483
Exosomes as messengers between mother and fetus in pregnancy. Int J Mol Sci. 2020; 21 (12): E4264.
Kluszczyńska K, Czernek L, Cypryk W, Pęczek Ł, Düchler M. Methods for the determination of the purity of exosomes. Curr Pharm Des. 2019; 25 (42): 4464-85.
Düchler M, Czernek L, Peczek L, Cypryk W, Sztiller-Sikorska M, Czyz M. Melanoma-derived extracellular vesicles bear the potential for the induction of antigen-specific tolerance. Cells. 2019 Jul 2; 8(7). pii: E665.
Düchler M. Int”Dll”igent control of T-cell pathology in GVHD. Blood. 2018 Nov 15; 132(20):2112-2114.
Cypryk W, Nyman TA, Matikainen S. From inflammasome to exosome – does extracellular vesicle secretion constitute an inflammasome-dependent immune response? Front Immunol. 2018 Sep 25; 9:2188.
Nyman TA, Lorey MB, Cypryk W, Matikainen S. Mass spectrometry-based proteomic exploration of the human immune system: focus on the inflammasome, global protein secretion, and T cells. Expert Rev Proteomics. 2017 May; 14(5):395-407.
Wozniak M, Peczek L, Czernek L, Düchler M. Analysis of the miRNA profiles of melanoma exosomes derived under normoxic and hypoxic culture conditions. Anticancer Res. 2017 Dec; 37(12):6779-6789.
Czernek L, Düchler M. Functions of cancer-derived extracellular vesicles in immunosuppression. Arch Immunol Ther Exp (Warsz). 2017 Aug; 65(4):311-323.
Düchler M, Leszczyńska G, Sochacka E, Nawrot B. Nucleoside modifications in the regulation of gene expression: focus on tRNA. Cell Mol Life Sci. 2016 Aug; 73(16):3075-95.
Czernek L, Chworos A, Düchler M. The uptake of extracellular vesicles is affected by the differentiation status of myeloid cells. Scand J Immunol. 2015 Dec; 82(6):506-14.
Düchler M, Peczek L, Szubert M, Suzin J. Influence of hypoxia inducible factors on the immune microenvironment in ovarian cancer. Anticancer Res. 2014 Jun; 34(6):2811-9.
Gajos-Michniewicz A, Düchler M, Czyz M. MiRNA in melanoma-derived exosomes. Cancer Lett. 2014 May 28; 347(1):29-37.
Düchler M, Peczek L, Zuk K, Zalesna I, Jeziorski A, Czyz M. The heterogeneous immune microenvironment in breast cancer is affected by hypoxia-related genes. Immunobiology. 2014 Feb; 219(2):158-65.